J Neuroinflammation︱爱尔眼科徐和平团队揭示老龄加重视网膜纤维化的机制
视网膜黄斑纤维化常见于新生血管型年龄相关性黄斑变性(neovascular age-related macular degeneration,nAMD),nAMD的主要治疗方法是眼内注射新生血管因素(vascular endothelial growth factor,VEGF)抑制剂,但有大约 40%-70%的治疗眼最终发展为黄斑纤维化[1-3],引起永久性黄斑部结构破坏及不可逆的视力损伤[4]。深入研究老年性黄斑纤维化的发病机制,寻找有效的治疗方法成为必要。
老龄相关的纤维化是影响老年人器官功能下降的重要原因,老龄加重肝、肺、肾,视网膜等组织纤维化的风险[5-9],但其机制不明。巨噬细胞参与组织损伤修复的各个阶段,在纤维化疾病中发挥重要作用,老化影响巨噬细胞的吞噬、迁移、细胞因子分泌、抗原提呈等功能[10]。纤维细胞起源于骨髓间充质干细胞,进入血液循环,可被募集到病灶,被活化后参与损伤修复。循环血纤维细胞的数量被作为判断特发性肺纤维化和心房纤维化的预后指标之一[11-13]。这些细胞在黄斑纤维化中的作用及年龄对他们的影响目前尚不清楚。
2023年2月23日,中南大学爱尔眼科学院、爱尔眼视光研究所徐和平教授团队在Journal of Neuroinflammation上发表了题为“Old age promotes retinal fibrosis in choroidal neovascularization through circulating fibrocytes and profibrotic macrophages”的文章,研究发现视网膜损伤修复过程中存在募集纤维细胞/巨噬细胞的视网膜-骨髓-血液-视网膜信号通路,老龄使巨噬细胞促纤维化功能增加,同时募集更多的循环纤维细胞从而加重视网膜黄斑纤维化。该研究阐明了老龄加重视网膜纤维化的机理,为继发nAMD黄斑纤维化的临床治疗提供新的思路。易彩娇为论文第一作者,徐和平教授为论文通讯作者。(拓展阅读:徐和平团队相关研究进展,详“逻辑神经科学”报道(点击阅读):Prog Neurobiol 前沿性思考丨遗传因素、衰老和肠道微生物失调对“干型”和“湿型”视网膜退行性变中免疫反应的影响)

首先,作者通过二次激光诱导视网膜下纤维化,同时比较年轻、年老小鼠视网膜下纤维化病灶 (collagen-1+)和病理性血管(CD31+)病灶的大小,发现年老小鼠的病灶明显大于年轻小鼠(图1A-F),证实了老龄促进视网膜下纤维化的形成。
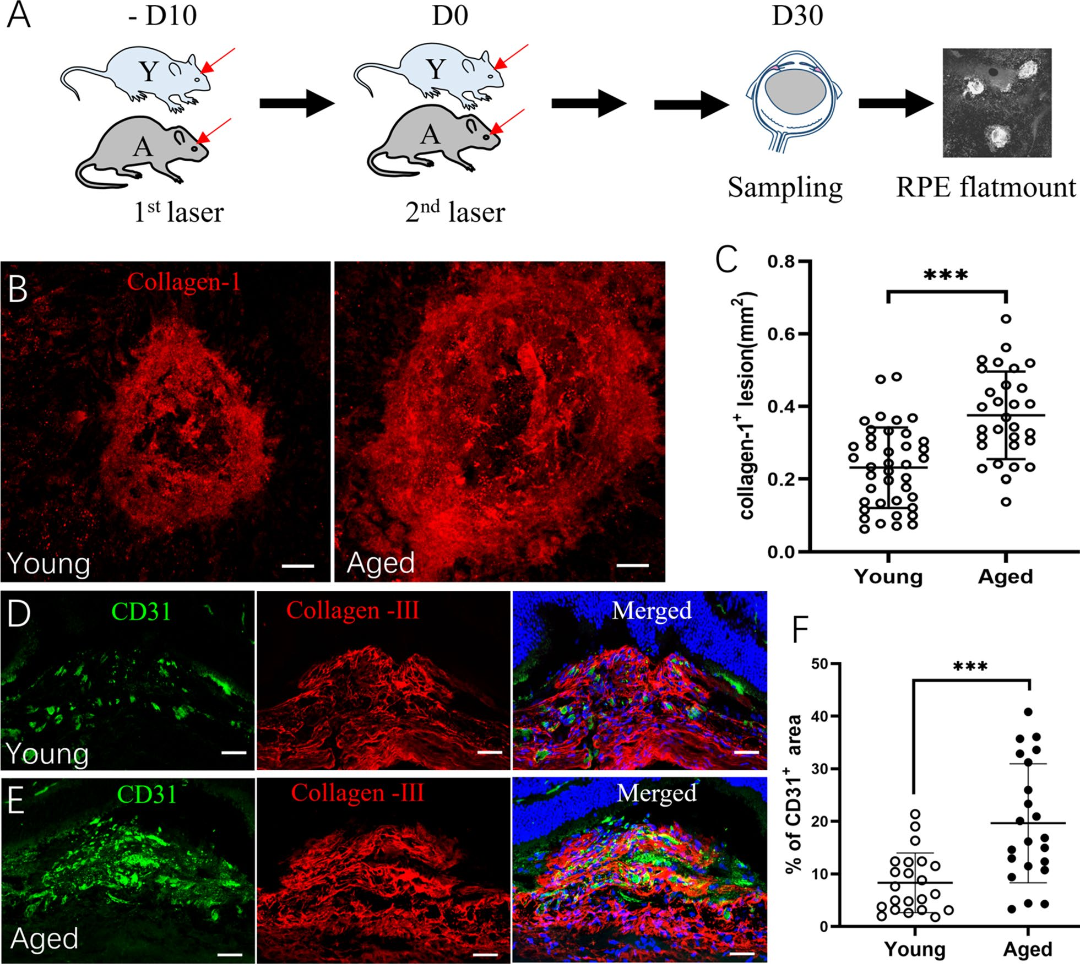
图1 年轻和年老小鼠视网膜下纤维化病灶
(图源:Yi C et al., J Neuroinflammation, 2023)
为进一步探讨老龄加重视网膜下纤维化的机制,作者检测了年轻、年老小鼠骨髓、血液中CD45+Collagen-1+纤维细胞的数量,发现在正常和视网膜纤维化状态下,年老小鼠血液中纤维细胞都高于年轻小鼠(图2A-C,F-I);视网膜激光损伤能显著增加骨髓中CD45+Collagen-1+纤维细胞的数量(图2D-E),提示:(1)老龄使循环纤维细胞的数量增加;(2)视网膜损伤的信号能很快传送到骨髓。

图2 年轻和年老小鼠骨髓和血液中的纤维细胞
(图源:Yi C et al., J Neuroinflammation, 2023)
作者还检测了年轻、年老小鼠视网膜下纤维化病灶中的CD45+Collagen-1+纤维细胞,发现年老小鼠病灶中纤维细胞的数量及比例都高于年轻小鼠(图3A-H),而且循环血纤维细胞数与视网膜病灶大小、病灶中纤维细胞比例均呈正相关(图3I-L),表明视网膜损伤时存在募集纤维细胞的“血液-视网膜”轴信号通路,老龄通过增加纤维细胞的募集促进视网膜纤维化。
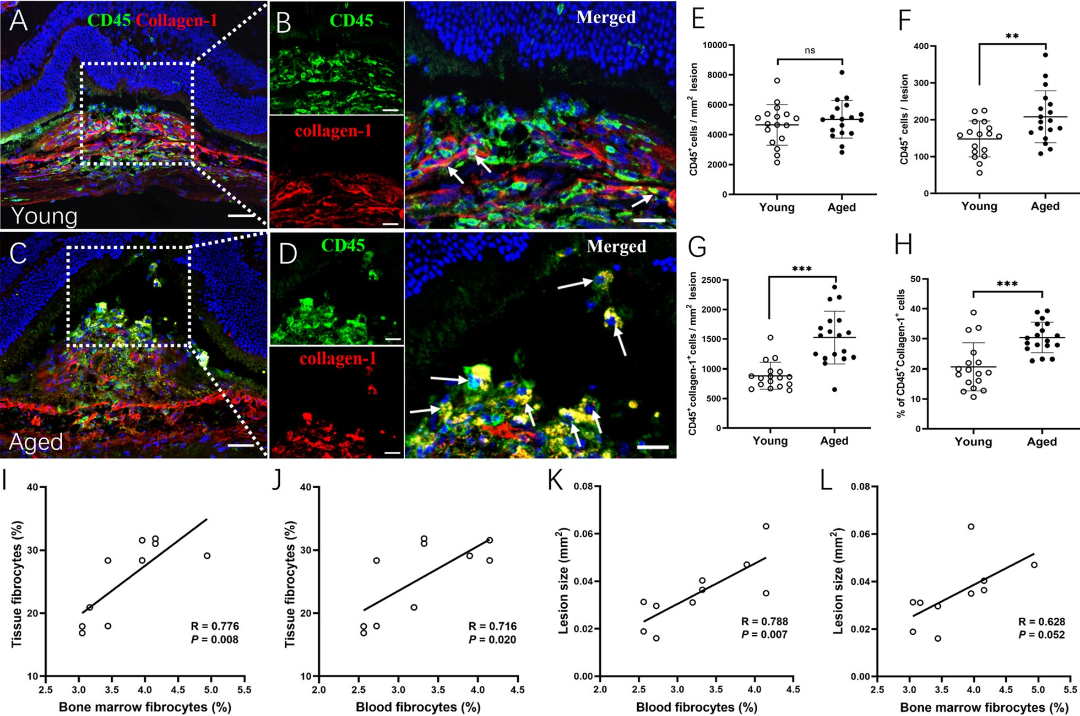
图3 年轻和年老小鼠视网膜下纤维化病灶中的纤维细胞
(图源:Yi C et al., J Neuroinflammation, 2023)
巨噬细胞参与伤口修复及纤维化疾病形成。作者通过qPCR、免疫荧光染色检测了骨髓源巨噬细胞(Bone marrow-derived macrophages ,BMDMs)促纤维化的相关指标,发现研究年老BMDM表达更高的促纤维化介质Tgfb1(图4A-F),说明年老的巨噬细胞具有更强的促纤维化潜能。
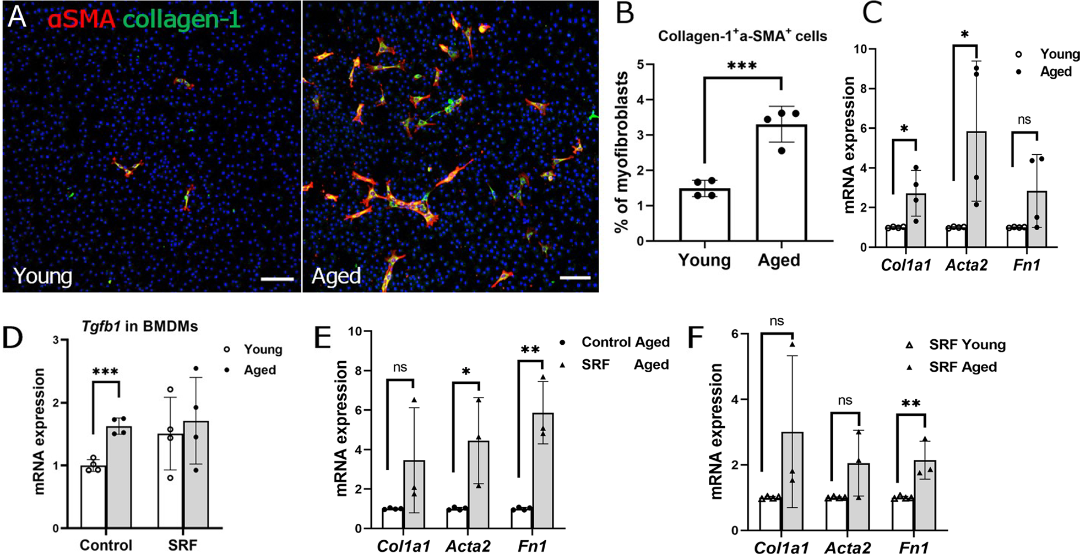
图4 纤维化指标在年轻和年老小鼠骨髓源巨噬细胞的表达
(图源:Yi C et al., J Neuroinflammation, 2023)
作者前期研究发现巨噬细胞-肌成纤维细胞转化(macrophage-to-myofibroblast transition ,MMT)在视网膜下纤维化中发挥重要作用[14, 15]。在本课题中用TGFβ1刺激年轻、年老小鼠巨噬细胞,建立巨噬细胞MMT体外模型,检测纤维化相关指标的表达(图5A-D)。研究结果表明年老巨噬细胞具有更强的MMT的能力。
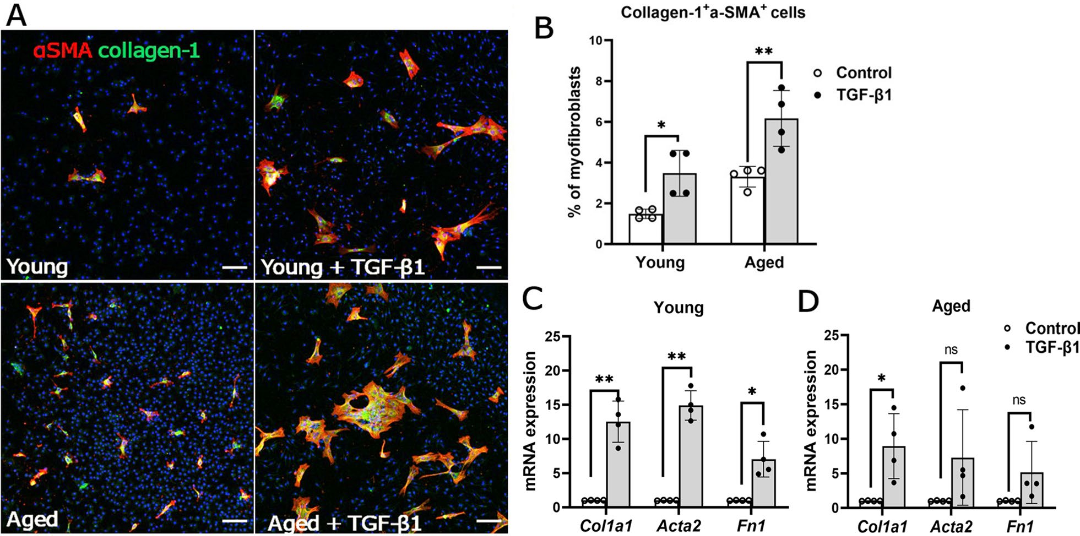
图5 年轻和年老小鼠骨髓源巨噬细胞的巨噬细胞向肌成纤维细胞转化
(图源:Yi C et al., J Neuroinflammation, 2023)
作者还比较了年轻、年老小鼠视网膜下纤维化病灶中巨噬细胞的MMT情况,结果表明年老小鼠视网膜下纤维化病灶中的F4/80+巨噬细胞数和F4/80+Collagen-1+细胞比例均明显高于年轻小鼠(图6A-F),说明年老小鼠视网膜下纤维化病灶的巨噬细胞也同样具有更强的MMT的能力。
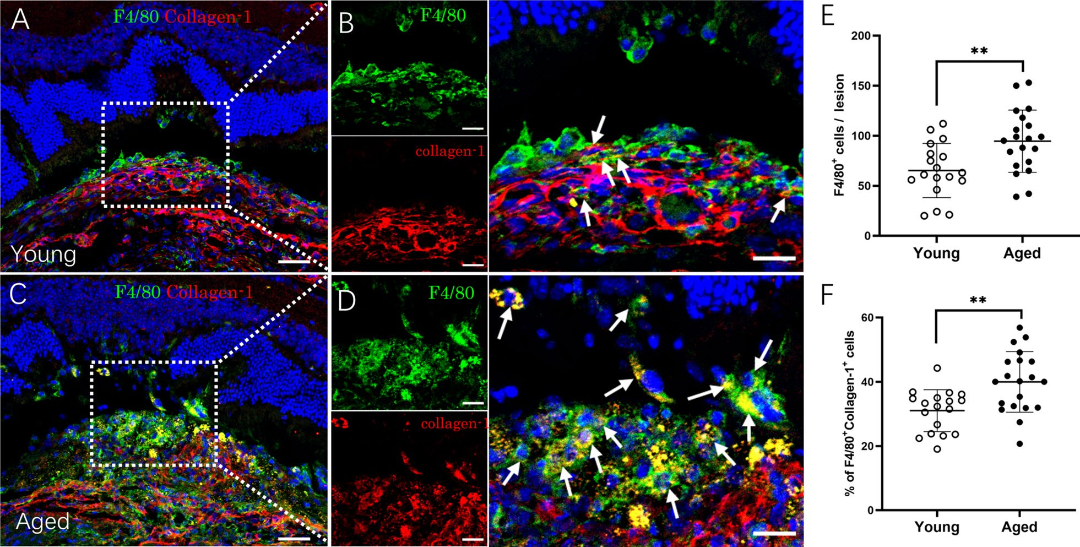
图6 年轻和年老小鼠视网膜下纤维化病灶中的巨噬细胞向肌成纤维细胞转化
(图源:Yi C et al., J Neuroinflammation, 2023)
为了进一步明确骨髓来源的细胞对视网膜下纤维化的作用,作者将年老小鼠(22 月龄,CD45.2)的骨髓移植到年轻小鼠中(2月龄,CD45.1)(Bone marrow transplantation, BMT),发现与没有进行BMT的年轻小鼠相比,接受年老小鼠骨髓的年轻小鼠(BMT)视网膜下纤维化病灶面积显著增加(图7A-F)。这个结果进一步证明年老的骨髓细胞更能促进视网膜纤维化的形成。
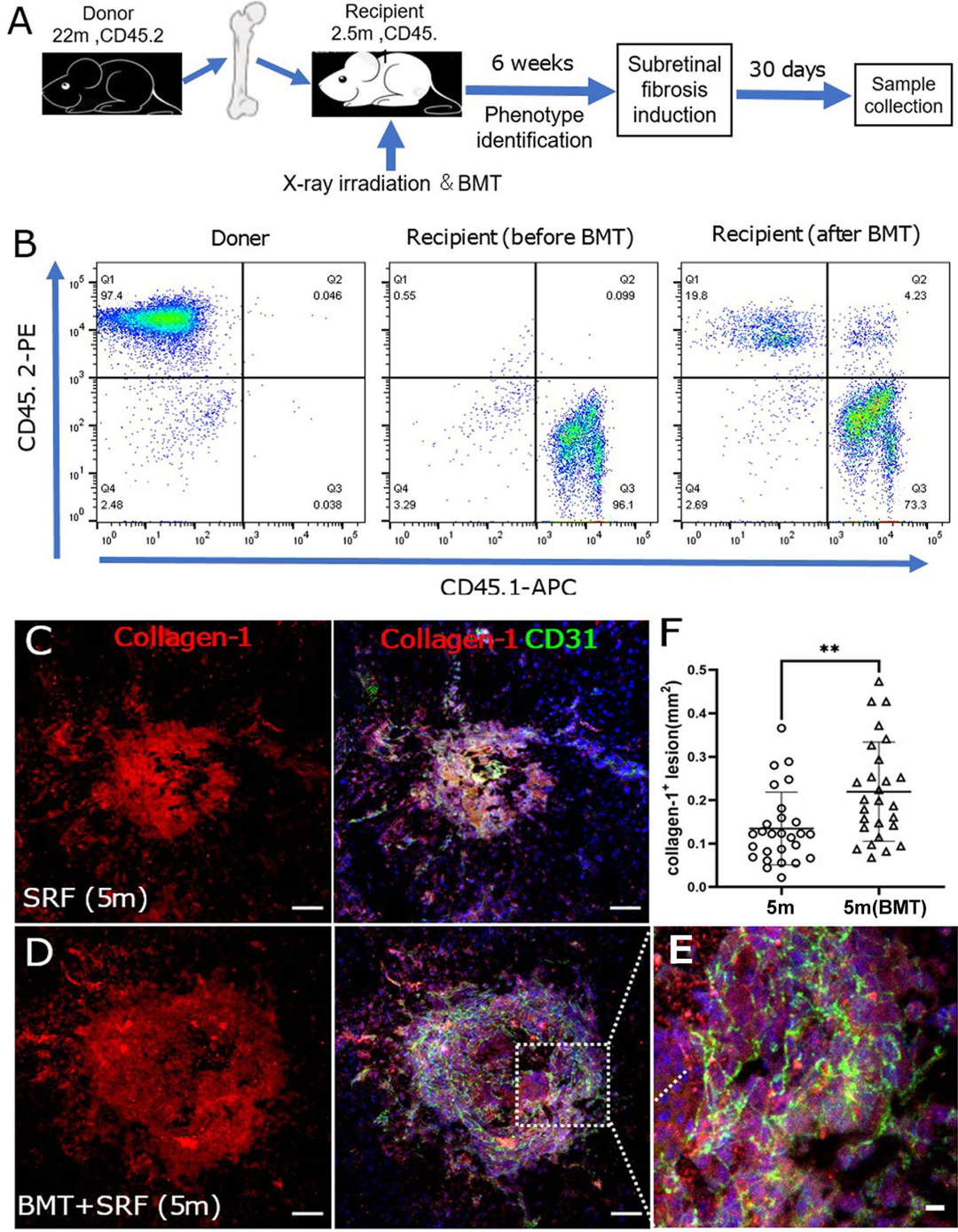
图7 移植到年轻小鼠的年老骨髓细胞对视网膜下纤维化病灶的影响
(图源:Yi C et al., J Neuroinflammation, 2023)
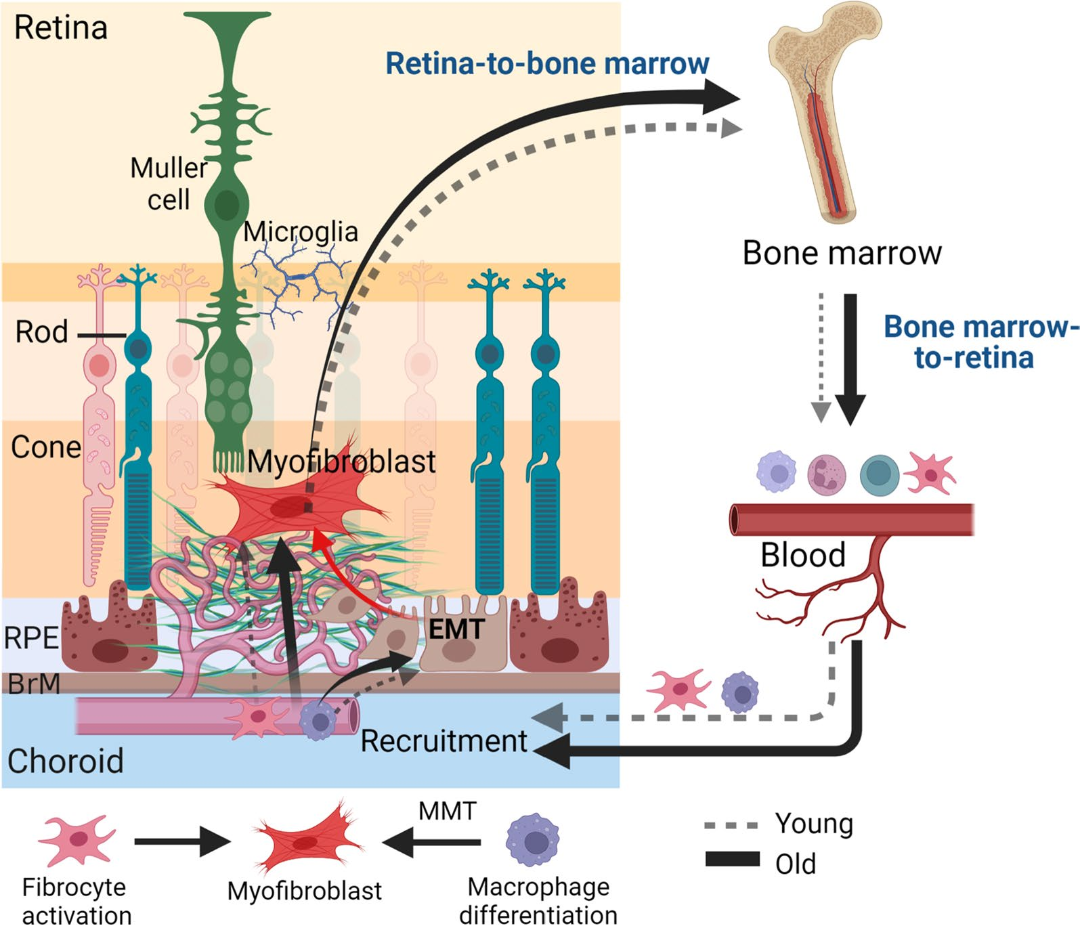
图8 募集纤维细胞/巨噬细胞参与视网膜损伤修复的视网膜-骨髓-血液-视网膜信号通路
(图源:Yi C et al., J Neuroinflammation, 2023)
本研究以骨髓巨噬细胞和循环血纤维细胞为切入点,通过体内视网膜纤维化小鼠模型与体外实验相结合,研究老龄促进视网膜纤维化的机制,发现骨髓及血里面的纤维细胞在老龄鼠占比更高,老龄鼠的巨噬细胞有更强的促纤维化的能力。此外,该研究还发现在视网膜受损伤时,存在募集纤维细胞和巨噬细胞的视网膜-骨髓-血液-视网膜信号通路(图8),视网膜的损伤信号能迅速传递给骨髓,骨髓动员纤维细胞释放入血液循环,并募集到视网膜参与损伤修复;同时,骨髓来源的巨噬细胞也被募集到视网膜,参与组织修复及纤维化的形成。这种募集纤维细胞和巨噬细胞的视网膜-骨髓-血液-视网膜信号通路在年老状态下更明显(图8)。基于这些发现,徐教授课题组正在进一步深入研究调控这个信号通路的分子机制及老龄影响纤维细胞和巨噬细胞功能的分子机制。这些研究将为防治视网膜纤维化的提供新策略,为开发安全、有效的治疗nAMD黄斑纤维化的方法奠定基础。作者认为该研究成果也将有助于理解老龄相关的肺、肝、肾等其他器官纤维化的机制。

徐和平团队(照片提供自:爱尔眼视光研究所徐和平教授团队)
作者简介:徐和平教授是英国贝尔法斯特女王大学终身正教授,爱尔眼视光研究所教授。徐教授是国际知名眼免疫学家,他的研究主要聚焦在视网膜免疫反应的激活和调控及炎症在老年黄斑变性、糖尿病视网膜病变等致盲性眼病的发生、发展中的作用机制,为这些眼病寻求有效、安全的治疗方法。更多关于Xu Lab资讯请访问https://pure.qub.ac.uk/en/persons/heping-xu。此外,徐教授实验室诚聘不同学科背景的副研究员、博士后以及科研助理,待遇从优,欢迎对视觉科学感兴趣的有志青年加入。